|
�P�D�͂��߂�
�@�@���ː����i�͕��ː�������ː��j������{�̂Ƃ��āC���ː��j�펩�̂��邢�͉������̑g�D�W�ϐ��𗘗p���C���ː��j���a�ϕ��ʂɏW�ς����邱�ƂŁC�f�f���邢�͎��Â��s�Ȃ����i�ł���B���ː����i�̗��j�͌Â��C���ː����i�̓��{��Ǖ��ɊY��������ː����i���1959
�N�ɐ��肳��C���ː����E���i�g���E������ѕ��ː������_�i�g���E���֘A5 �i�ڂ����ڂ���Ă���1�j�B�Ȍ�C�l�X�ȕ��ː��j���j������̑����g�D�ɗA������L�����A���q�̊J�����i�݁C�g�D���ߐ��ɗD�ꂽ�����𗘗p�����摜�f�f�ł���SPECT�iSingle-photon
emission computed tomography�j��PET�iPositron emission
tomography�j�Ȃǂɗp����f�f��C���邢�̓���������𗘗p�����f�f�E���Ö�Ȃǂ����F����Ă���B����������̓����Ɣ�r���Ĕ�����Z���C�����g�D��Q�����������ƂŎ��Ì��ʂ����҂���Ă������C�����ɕa�ϕ��ʂɏW�ς����邩���L�����E���S���������ʼnۑ�ł������B�ߔN�C�h���b�O�f���o���[�V�X�e���iDDS�j�Z�p�̐i�W�ɂ��C�g�D�I��I�ɖ�܂�A�����邱�Ƃ��\�ɂȂ������Ƃŕ��ː����i�̗��p���g�債�Ă���2�j�B���̒��ŁC���ː����i�͊j������ւ��邱�ƂŁC�f�f�݂̂Ȃ炸���Â��s�Ȃ����Ƃ��ł��邽�߁C�Z���m�X�e�B�N�X�iTheranostics
��Therapy and diagnostics�j�Ƃ��Ē��ڂ��W�߂Ă���C���l�ȕ��ː��j��ƃL�����A���q��g�ݍ��킹�����ː����i�̊J�������������Ă���3,4�j�B����ŁC���ː����i�ɂ͉ۑ���c����Ă���B���ː����i�ɗ��p�������ː��j��͈�ʂɒZ�������ł��邱�Ƃ���ۊǂ��ł��Ȃ����C���̑����͗A���ɗ����Ă��邽�߁C�ЊQ�⍑�ێ���ɂ��A������ƒ����ɋ����Ɏx��𗈂��C���Y��Ís�ׂ��s���Ȃ��Ȃ�Ƃ�����肪������B���̕��ː����i�̈��苟���̖��ɂ��ẮC���q�͈ψ���ɂ���×p�����W�I�A�C�\�g�[�v�����E���p���i�A�N�V�����v�������쐬����C���ː��j��̍��Y����ڎw�������g�݂����������čs���Ă���B�ʂ̉ۑ�Ƃ��āC��L�̒ʂ�C�ߔN�J���̈悪�g�剻���Ă�����ː����i�Ɋւ���K�����ǂ����Ă��炸�C�V�K���ː����i�̏��F�\���ɂ�����v���������K���������m�ɂȂ��Ă��Ȃ����Ƃ���������B�{�e�ł́C�{�M�̕��ː����i����芪���K���v�����̏ɂ��ďЉ��B
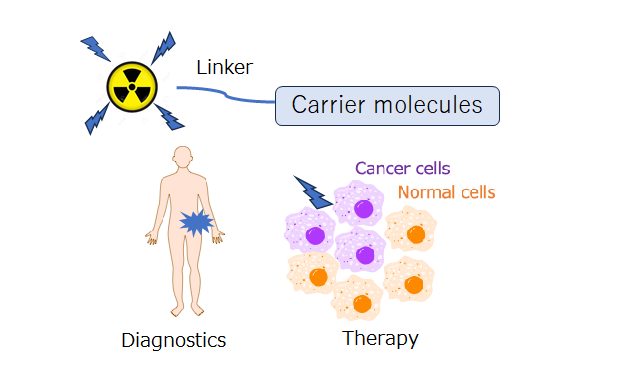
�}�P�@�Z���m�X�e�B�b�N�Ή����ː����i�̊T�v
�Q�D���ː����i�̍�������я��O���̋K����
�@���ԂƂƂ��Ɍ���������ː��j���L������ː����i�́C��ʓI�Ȉ��i�Ƃ͈قȂ�Ȋw�I�����̂��߁C������ICH
�������œK�p���O����Ă���B����ŕ��ː����i�Ɋւ��鍑���̎w�j�́C�u�f�f�p���ː����i�̗Տ��]�����@�Ɋւ���K�C�h���C���i����24
�N6 ���j�v�݂̂ƂȂ��Ă���C�����J���E���F�\���̊e�i�K�ɂ�����v�����������ĂɎ�����Ă���Ƃ͌�����C���ː����i�̉~���Ȍ����J���E���F�\���ɂ����Ė��ƂȂ��Ă���B�������ː����i�Ɋւ���K���v���̖��������{�M�ɂ�������ː����i�̎s��J���̊������ɂ����Ă͏d�v�ƍl������B
�@�ߔN�C���ď����y�э��ۋ@�ւɂ����Ă����ː����i�Ɋւ��镶���쐬���ϋɓI�ɐi�߂��Ă���C�i������є�Տ������ɑ��镶�����������������5-11�j�B���̂��߁C�{�M�ɂ����Ă����×p���ː����i�Ɋւ���i���E��Տ��K�C�h���C���̐������v�]����Ă���B���̂悤�Ȕw�i�̂��ƁC�V�K�̎��×p���ː����i�̐����̔����F�\������їՏ������J�n�ɕK�v�Ȕ�Տ������C���тɗՏ����������{����ꍇ�ɍl�����ׂ���{�I��������邱�Ƃ�ړI�Ƃ��āC���×p���ː����i�̔�Տ������K�C�h���C���Ă��쐬���ꂽ�B���×p���ː����i�͎�Ɉ�����ᇂ̎��Âɗp������ꍇ���������C���̑��̎������ΏۂɂȂ蓾��B�{�e�ł́C2025
�N�Ƀp�u���b�N�R�����g�ɂ�����ꂽ�u���×p���ː����i�Ɋւ����Տ����S���K�C�h���C���i�āj�v�ɂ��Ĉ�ʓI�Ȉ��i�ƈقȂ�_�ɒ��ڂ��ďЉ��B
�@
�R�D���ː����i�̔�Տ�����
�@�@��̓I�Ȏ����v�����������O�ɁC�{�e�ɂ�������ː����i�̔팱�����̕��ނɂ��Ē�`����K�v������B�K�C�h���C���Ăł͕��ː����i���C�@
�L�������C�A ���萫���ʑ̒u���́C�B ���W���́C��3 �ɕ����Ă���B�@ �͕W�I���ʂւ̑��B�ɕK�v�ȕ��q�ƃ����J�[����ѕ��ː��j����܂݁C�A
�ł͊j������蓯�ʑ̂ɒu�������������C�B �͕��ː��j��W���O�̉������ł���C�A �ƈقȂ�j�킪���ʑ̂ł͂Ȃ����̌��f�̈���j����܂މ�������C�L���[�g������Ă��Ȃ����������w���B�ڍׂ͕\1
���Q�Ƃ��ꂽ���B���ː����i�́C����ː������Ƃ��ď����q�݂̂Ȃ炸�C�y�v�`�h�E�^���p�N���ȂǕ��L�����_���e�B�𗘗p���Ă���C����ɂ���ɑ��l�ȕ��ː��j���g�ݍ��킹�邽�߁C���̐����͈��i�i�ڂ��Ƃɑ傫���قȂ�B���̂��߁C�ꗥ�̔�Տ������̎��{�ł͂Ȃ��C���̐��܂��Ƃ̐����ɍ��킹���P�[�X�o�C�P�[�X�ł̏_��ȕ]����@���K�v�ȏꍇ������Ƃ����B
�@�ȉ��ɁC���×p���ː����i�̔�Տ����S���K�C�h���C���ĂɋL�ڂ���Ă���e�����v���̒��ŁC���ː����i���L�̂��̂ɂ��Đ�������B�e���ڔԍ��́C�K�C�h���C���̒��Ŏg�p����Ă���ԍ���p���C�`����GL
��Y������B
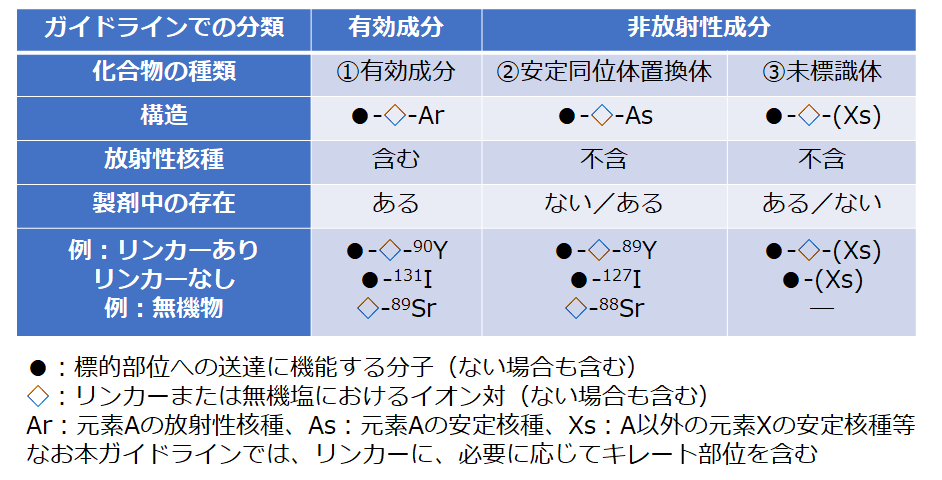
�\�P�@��Տ����S���K�C�h���C���ɂ�������ː����i�̒�`
�@
GL�@2. ��Տ���������э���
�@���×p���ː����i�̔�Տ��]���́C���ː��j��̉�ςɂ�萶������ː��̉e���Ɣ���ː������̐��̓��ւ̔��I�ɂ�萶����e���ɒ��ڂ���K�v������B�j��ςɂ����o�������ː����I�Ɋ�Â��e���ɂ��ẮC���ː��̎�ނƗʂ��l�����āC��Տ����S�������̍��ڂ̗v�ۂ��������邱�Ƃ͉\�ł���B���ː����I�ɂ��Ő��Ɋւ��ẮC�K�ȕ��������̕]�����\�ł���B����C�W���ɗp�������ː��j��̌��f�i����ː��j����܂ށj�y�с^���͔���ː������̂����̌��f�ȊO�̕����ɂ��āC�q�g�ֈ��i�Ƃ��Ă̓��^�o�����R�������C�V�K���̍��������̏ꍇ�ɂ́C����ː������i�W���ɗp�������f�̈��蓯�ʑ̒u���́C���蓯�ʑ̂��Ȃ��ꍇ�͖��W���́C�p�����y�ѕ\1
�Q�Ɓj��p���āC���i�̐V�K�L�������ɏ�������Տ����S���]�����K�v�ł���B���̏ꍇ�C�V�K����ː������̔�Տ����S���]���ɕK�v�ȍ��ڂ́C���Y���i�̕������w�I����4
�y�ѓK�p�����ɉ����āCICH M3, ICH S6 �y��ICH S9 �̊e�K�C�h���C�����Q�l�Ƃ��邱�Ƃ͉\�ł���B
�@���{�e�̑S�e�́u����PHARMSTAGE�v�Q�O�Q�T�N�T�����@�{���ł�������������
�@�@����PHARMSTAGE�̃z�[���y�[�W�͂�����
�@�@https://www.gijutu.co.jp/doc/magazine_pharm%20stage.htm
�Q�l����
1�j���ː����i����C���ː����i�������C2016 �N6 ���C
�@�@http://www.houyakkyou.org/img/housha_img/kaisetsu_160630.pdf
2�jZhang T, Lei H, Chen
X, Dou Z, Yu B, Su W, Wang W, Jin X, Katsube T,
Wang B, Zhang H, Li Q, Di C. Cell Death Discov.
10, 16 (2024)
3�jMunekane M, Fuchigami
T, Ogawa K. Anal Sci. 40 (5), 803-826(2024)
4�jSallam M, Mohammadi M,
Sainsbury F, Nguyen NT, Kimizuka N,Muyldermans
S, Bene?ova-Schafer M. Front Oncol. 14, 1397790(2024)
5�jEuropean medicines agency,�g
Concept paper on the revision of the Guideline
on Radiopharmaceuticals�h�C2023 �N7 ��
6�jEuropean medicines agency,�g
Guideline on the non-clinical requirements for
radiopharmaceuticals (Draft)�h�C2018 �N11 ��
7�jU. S. Food and drug administrations,�g
Guidance for Industry :Oncology Therapeutic Radiopharmaceuticals
: Nonclinical Studies and Labeling Recommendations�h
2019 �N8 ��
8�jU. S. Food and drug administrations,�g
Nonclinical Evaluation of Late Radiation Toxicity
of Therapeutic Radiopharmaceuticals�h2011 �N11 ��
9�j�gIAEA/WHO guideline on
GMP for investigational radiopharmaceutical products.�hWHO
Technical Report Series 1044, WHO Expert Committee
on Specifications for Pharmaceutical Preparations
56th report, Annex3 (2022).
�@�@https://cdn.who.int/media/docs/default-source/medicines/normsand-standards/guidelines/production/trs1044-annex3-good-manu
facturing-practices-for-radiopharmaceutical-products-(1).pdf?sfvrs
n=fa6af369_1&download=true
10�j�gIAEA/WHO guideline
on GMP for radiopharmaceutical products.�hWHO Technical
Report Series 1025, WHO Expert Committee on Specifications
for Pharmaceutical Preparations 54th report, Annex
2 (2020).
�@�@https://cdn.who.int/media/docs/default-source/medicines/who-technical-report-series-who-expert-committee-on-specifications-for-pharmaceutical-preparations/trs1025-annex2.pdf?sfvrsn=7aceb0c1_6
11�j�gIAEA/WHO good manufacturing
practices for in-house coldkits for radiopharmaceutical
preparations.�h WHO Technical Report Series 1052,
WHO Expert Committee on Specifications for Pharmaceutical
Preparations 57th report, Annex 3 (2024).
�@�@https://cdn.who.int/media/docs/default-source/medicines/norms-and-standards/current-projects/qas23_932_gmp_for_in-house_cold_kits_for_radioph_prep_public-consultation.pdf?sfvrsn=cfbff75b_1
|