|
1.はじめに
製薬業界では,安全性と品質を確保しながら,新しい医薬品の製造を短期間で立ち上げて市場に供給することが求められている。近年のCOVID-19
のパンデミックにおいては,ワクチンの開発から製造までを迅速に実現することの重要性が認識された。同様なパンデミックに備えるためには,デジタル化によって変化に柔軟に対応できる生産システムが必要である。
本稿ではシーメンスが提供する製造のデジタル化ソリューションについて紹介する。製造データを取得して統合管理することで,正確な製造記録と品質管理の要求に応える。図1は医薬品製造に関連する製品群を示している。個々のプロセスをデジタル化する個別最適にとどまらず,いかにデータ連携を進めていくかが全体最適を実現するための鍵となる。このためには二つの統合軸を考慮する必要があり,そのうちの一つの統合軸は,製造現場の機器からデータを集約して統合管理するための垂直統合である。また,もう一つの統合軸は水平統合で,開発から製造までの各工程を,紙ではなくデジタルデータで連携して効率化していく。このデジタルデータを用いた水平軸の連携は,昨今“デジタルスレッド(=デジタルの糸)と呼ばれる。
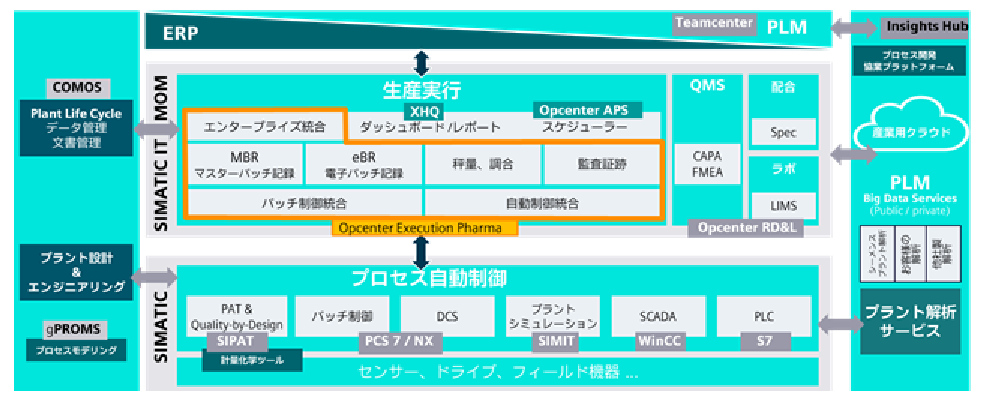
図1 医薬品製造に関連する製品群
2.データインテグリティを遵守するSCADA システム
日本においては,SCADA を使わずに,製造現場のPLC
とMES などの上位のIT システムを直接つなぐ例もみられるが,このような構成ではPLC 個別のプロトコル対応や,PLC
が持つ大量のデータから必要なデータを抽出する処理がMES に集中するためにMES の負荷が重くなってしまうという問題点がある。このため,SCADA
を使ってデータを収集して,品質管理に重要なパラメーターを抽出し,統一したフォーマットでMESなどの上位IT
システムに提供する形が望ましい。
SIMATIC WinCC はシーメンスのSCADA システムで,様々な生産設備からデータを収集して統合,表示および記録することができるが,特に製薬業界向けにはWinCC
Audit の監査証跡オプションを提供している。これにより作業者が操作した履歴を専用のデータに保存,管理することができ,データインテグリティに対応する。製品の品質管理のために重要なパラメーターを格納するタグを指定しておけば,そのタグを監視して値が変更された時に確実に履歴を残すことができる。また,誰が操作したのかを特定して記録するために電子署名を要求できる。このWinCC
Audit を導入すると,万が一記録されたデータが改ざんされた場合に検知するためのチェックサムが組み込まれるため,記録が改ざんされていないことを検証できる。製薬業界で必須となるデータインテグリティの機能を持っていることが,SIMATIC
WinCCの特長の1つになっている。
また,SIMATIC WinCC は多彩なオプションを持っており,必要に応じて機能を付加できる。機器を操作する時にはGMP
の要件からユーザー認証が必須となるが,毎回パスワードを打ち込むのは煩雑である。RFIDカードを用いてユーザー認証を行うPM-Logon
を導入すれば,RFID カードを読み取り装置にかざすだけで簡単にユーザー認証できる。最近では生体認証の機能を持つデバイスと連携してユーザー認証している事例もある。このほか,装置単位でバッチレポートを作成するPM-Quality
がある。これはバッチごとに製造データを記録し,レポートを作成する機能を持っている。レポートにはタグの値を表示するほか,トレンドグラフや表形式のデータを入れることもでき,わかりやすい製造記録を残すことができる。
原薬製造工程においては一般的にDCS が用いられるが,シーメンスのDCS であるPCS 7
は,ここで紹介したSIMATIC WinCCの機能を組み込んでいるために,データインテグリティの機能が同様に利用できる。
なお,SCADAは様々なシステムからデータ収集できる汎用性も重要である。生産設備には様々なベンダーのコントローラーが搭載されており,通信プロトコルやデータ構造がバラバラになっていることも多い。最近ではベンダーに依存しないデータ通信プロトコルとしてOPC
UAが標準化されており,SIMATIC WinCC はOPC UA に対応した装置であればベンダーを問わずデータを収集できるようになっている。さらにOPC
UA に対応していない場合でも,多くの通信プロトコルに対応してデータ収集できる。
3.MTP のモジュールによる効率的な開発
近年では製品ライフサイクルが短くなり,多品種少量生産が求められるようになっている。このためには新しい生産設備の設計を効率よく行い,製品の市場供給までにかかる期間を短縮する必要がある。従来は生産ライン全体の制御システムを一括して開発していたのに対して,新しいコンセプトとして機能ごとのモジュールに分割して開発し,そのモジュールを組み合わせて生産ラインを構築するというモジュールタイプパッケージ(MTP)が注目されている。MTP
はドイツの業界団体であるNAMUR,ZVEI,VDI が中心になって標準化作業を進めている。シーメンスを含めた制御機器ベンダーや,エンドユーザーとなる化学・製薬メーカーもMTP
の標準化に参加しており,IEC の標準規格を作成する作業を実施している。
図2 は現在主流となっている開発手法とMTP を比較したものである。図2 の左側では様々な異なる装置が1つのプロジェクトにまとめられており,中央のコントローラーで集中制御する形になっている。装置ごとに信号の仕様はバラバラで,個々の装置の仕様にあわせて制御プログラムを作成しなければいけない。また,一か所の仕様変更がプロジェクト全体に波及する可能性がある。これに対して図2
の右側のMTP の場合は,コントローラーを内蔵したモジュール単位で開発を行なう。製造工程ごとに単機能のモジュールを開発するため,モジュールごとに独立して動作検証ができるという利点がある。MTP
のモジュールを統合する役割を持つのがプロセスオーケストレーションレイヤー(POL)である。POL
は各モジュールの動作状態の監視や設定値を変更,モジュール間の動作を調停する役割を担う。MTP
の各モジュールとPOL との間の通信プロトコルはMTP の規格で標準化されているため,POL
の開発を容易にする。また,1 つのモジュール内部で仕様が変更された場合でも,基本的に他のモジュールには影響しないため,開発や検証の工数が削減できる。MTP
は必要なモジュールを組み合わせるだけで簡単に生産ラインを構築できるプラグ& プロデュースというコンセプトである。また,生産能力を増やしたい場合には,MTP
の同じモジュールの組み合わせを追加するだけで簡単に実現することができる。このようにして,市場のニーズの変化に素早く適応して生産することを目指している。
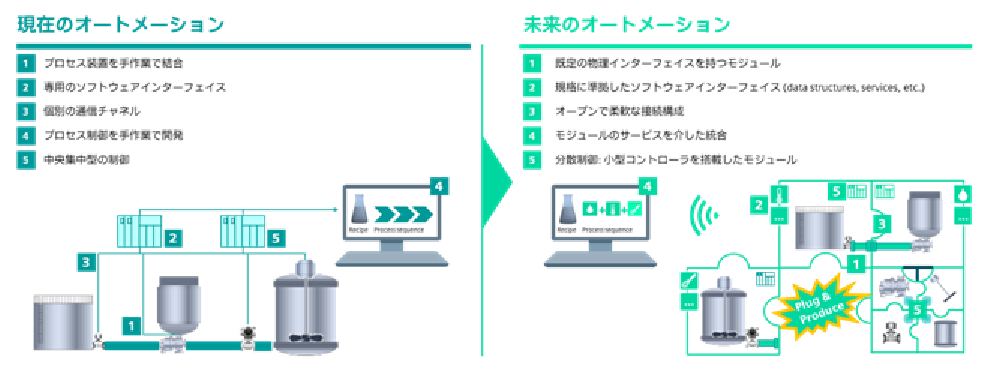
図 2 従来のエンジニアリング( 左) と,
MTP( 右) の比較
4.製薬業界のためのMES
厚生労働省が策定した「医薬品産業ビジョン2021」では,医薬品の品質確保・安定供給の重要性が指摘されている。これを実現するためには医薬品が承認された手順通りに生産されることを保証して,正確な記録を残すしくみが必要である。従来は紙で製造記録を管理してきたが,
紙の問題点は情報検索に時間がかかることである。更に近年では多品種少量生産の要求が増えているため,管理する情報量が膨大となり,情報管理の効率化が不可欠となってきた。MES
の電子バッチ記録は情報検索の点で優れており,手書き記録の判読性の問題も解消できることから注目されている。
あるメーカーで紙の記録で管理していた事例では,不適合とされた製品を追跡調査した結果,製品の品質には問題はなかったが,記録に間違いがあったため不適合となっていた事例が多く見つかった。MES
ではオンラインで取得可能なデータについては人手を介さずに記録できるため,人為的なミスを防いで不適合製品による損失を減らすことができる。
先に示した図1 では,医薬品製造に必要となるシステムを示しているが,シーメンスは医薬品製造のためのMES
としてOpcenter Execution Pharma を提供している。周辺のシステムとデータ連携ができるよう,多くのインターフェイスを持っており,生産現場のDCS
やSCADA と他社製品も含めて接続できるようになっている。また,検査で使用されるLIMS
や,在庫や生産計画を管理するERP との接続実績もあり,製造に関連した情報を集約して管理できる。
MES の主要な機能である製造プロセス設計,生産実行,逸脱のレビューをまとめたのが図3 である。1
番目の製造プロセス設計では,プログラミング等の高度なIT スキルは不要で,オフィス文書作成と同じような編集画面で設計できることが特長である。紙で製造指図を作成していたユーザーでも容易に移行できるよう直感的なインターフェイスになっており,紙と異なる点は入力されたデータをどのタグに紐づけるかを設定する作業が追加されるだけである。
◆この続きは「月刊PHARMSTAGE」2025年4月号 本誌でご覧ください◆
月刊PHARMSTAGEのホームページはこちら
https://www.gijutu.co.jp/doc/magazine_pharm%20stage.htm
|